Избыток и недостаток в химии как определить
Избыток и недостаток в химии как определить
Методика решения задач
на «избыток–недостаток»
в курсе основной
общеобразовательной школы
Умение решать химические задачи – важная составляющая знаний по предмету. Согласно государственному стандарту образования по химии учащиеся, оканчивающие школу, должны уметь решать более десятка типов стандартных задач. Среди них и задачи на «избыток–недостаток».
Предлагаю свой вариант подачи материала по решению таких задач в курсе химии 9-го класса.
На изучение этой темы отвожу 2–2,5 урока, в зависимости от уровня способностей учеников класса. Ознакомление с алгоритмом решения задач данного типа происходит в рамках изучения темы «Теория электролитической диссоциации». Однако если класс сильный, то в рамках эксперимента этот тип задач иногда изучаем и в конце 8-го класса в главе «Галогены», а высвободившееся время можно потратить на изучение органической химии в курсе 9-го класса.
На первом уроке разбираю два типа задач на «избыток–недостаток»:
 одно из двух вступивших в реакцию веществ дано в избытке;
одно из двух вступивших в реакцию веществ дано в избытке;
 оба вступивших в реакцию вещества расходуются на взаимодействие друг с другом без остатка, т. е. даны в стехиометрических количествах.
оба вступивших в реакцию вещества расходуются на взаимодействие друг с другом без остатка, т. е. даны в стехиометрических количествах.
В качестве домашнего задания обязательно предлагаются две-три задачи, подобные изученным на уроке.
На втором уроке закрепляю и углубляю изученный материал, ввожу понятия «процентная концентрация растворов веществ», вступивших в реакцию, «плотность растворов». Кроме того, усложняю задачи, вводя «процентное содержание примесей в исходном веществе» и т. д. Такой прием позволяет повторить элементы уже изученного материала, сэкономить время. В конце второго урока изучения темы или в начале третьего провожу небольшую самостоятельную работу на закрепление изученного материала, включающую одну-две задачи, причем самостоятельная работа предлагается в трех уровнях сложности, в зависимости от способностей ученика.
Урок 1
Решение задач на «избыток–недостаток»
Цели.
- научить алгоритму решения задач нового типа;
- закрепить навыки устного счета;
- повторить правила расчета относительных молекулярных масс веществ;
- закрепить правила грамотного оформления условия задачи;
- формировать навыки химического мышления, логики, а также способствовать воспитанию гармоничной, всесторонне развитой личности.
ХОД УРОКА
 Рассмотрим вариант, когда одно из вступивших в реакцию веществ дано в избытке, другое – в недостатке.
Рассмотрим вариант, когда одно из вступивших в реакцию веществ дано в избытке, другое – в недостатке.
Решая химические задачи, следует не забывать о правилах их грамотного оформления по схеме: дано, найти, решение, ответ.
ЗАДАЧА 1. На 47 г оксида калия подействовали раствором, содержащим 40 г азотной кислоты. Найдите массу образовавшегося нитрата калия.
Решение
Рассчитаем относительные молекулярные массы интересующих нас веществ:
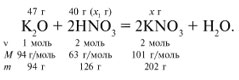
Для удобства расчета за х1 примем массу НNО3 и найдем, какое из веществ, вступивших в реакцию, дано в избытке, какое – в недостатке.
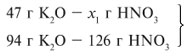
Следовательно, азотная кислота дана в недостатке, т. к. по условию ее 40 г, а по расчету необходимо 63 г, поэтому расчет ведем по HNO3:
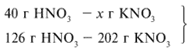
ЗАДАЧА 2. На 24 г металлического магния подействовали 100 г 30%-го раствора соляной кислоты. Найдите массу образовавшегося хлорида магния.
m(Mg) = 24 г,
m(р-р HCl) = 100 г,  (HCl) = 30%.
(HCl) = 30%.
Решение
Рассчитаем относительные молекулярные массы интересующих нас веществ:
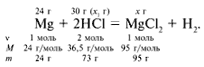
Для удобства расчета за х1 примем массу соляной кислоты и найдем, какое из веществ, вступивших в реакцию, дано в избытке, какое – в недостатке.
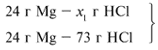
Из расчета видно, что соляная кислота дана в недостатке, т. к. по условию задачи ее дано 30 г, а для реакции требуется 73 г. Следовательно, расчет ведем по соляной кислоте:
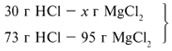
 Рассмотрим вариант, когда оба вступивших в реакцию вещества даны в стехиометрических количествах, т. е. реагируют друг с другом без остатка.
Рассмотрим вариант, когда оба вступивших в реакцию вещества даны в стехиометрических количествах, т. е. реагируют друг с другом без остатка.
ЗАДАЧА 1. На 36 г алюминия подействовали 64 г серы. Найдите массу образовавшегося сульфида алюминия.
Решение
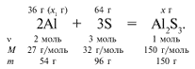
Примем массу Al за х1 и найдем, какое из веществ, вступивших в реакцию, дано в избытке, какое – в недостатке.
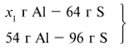
В данном случае вещества, вступившие в реакцию, взяты в стехиометрических количествах, поэтому расчет можно вести по любому из них:
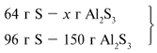
ЗАДАЧА 2. На раствор, содержащий 53 г карбоната натрия, подействовали раствором, содержащим 49 г серной кислоты. Найдите массу образовавшейся соли.
Решение
Рассчитаем относительные молекулярные массы интересующих нас веществ:
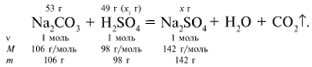
Примем за х1 массу cерной кислоты, чтобы узнать, какое вещество дано в избытке, какое – в недостатке.
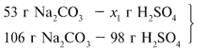
В данном случае оба вещества взяты в стехиометрических количествах, поэтому расчет можно вести по любому из них:
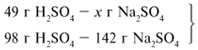
Однако учитель, подбирая задачи для решения в классе, должен помнить, что в некоторых случаях (например, если кислота или кислотный оксид дан в избытке) решение задачи не ограничивается расчетом двух пропорций, т. к. реакция будет протекать дальше с образованием кислой соли. Это повысит сложность материала. На первых уроках при решении задач данного типа я не включаю в материал задачи на прохождение реакций с образованием кислых или основных солей.
Домашнее задание
ЗАДАЧА 1. На 200 г 10%-го раствора серной кислоты подействовали 40 г оксида алюминия. Найдите массу образовавшейся воды.
M(р-р H2SO4) = 200 г, 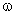 (H2SO4) = 10%,
(H2SO4) = 10%,
m(Al2O3) = 40 г.
Решение
Рассчитаем относительные молекулярные массы интересующих нас веществ:
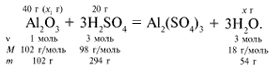
Найдем, какое из вступивших в реакцию веществ дано в избытке, а какое – в недостатке.
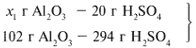
Из расчета видно, что Al2O3 дан в избытке, следовательно, расчет ведем по кислоте:
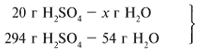
ЗАДАЧА 2. На 40 г оксида меди(II) подействовали раствором серной кислоты, содержащим 49 г безводного вещества. Найдите массу образовавшейся соли.
Решение
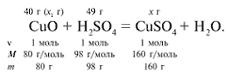
Найдем, какое из веществ, вступивших в реакцию, дано в избытке, а какое – в недостатке.
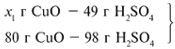
Cогласно уравнению данной реакции вещества взяты в стехиометрических количествах, поэтому расчет можно вести по любому из них:
Химия, Биология, подготовка к ГИА и ЕГЭ
Задачи такого типа (точнее, это может быть даже не самой задачей, а частью задачи) есть в части С ГИА, они входят в часть С ЕГЭ, теперь они появились и в части B.

Классический пример задачи на избыток и недостаток.
Этапы решения задачи:
1. Записываем уравнение реакции и уравниваем его:
2. Находим количество моль тех веществ, массы которых нам даны в условии:
n(Cu) = mAr =3.2 г 63.5 гмоль = 0,05 моль
m(Hg(NO3)2) = mMr = 20 324 = 0,06 моль
3. Сравниваем количество моль веществ и определяем недостаток:
0,05 моль 0,06 моль
по уравнению реакции меди и нитрат ртути реагируют 1:1, значит, их количество моль тоже должно быть одинаковым
0,05 моль ——> 0,05 моль
m(Hg)= n*Ar = 0,05 моль * 200 гмоль = 10 г
______________________________________________________________________________________
Пример задачи на избыток и недостаток,
где вещества в другом соотношении:

те же самые этапы решения:
1. Записываем уравнение реакции и уравниваем его:
2. Находим количество моль тех веществ, массы которых нам даны в условии:
n(N2 ) = mMr = 1428=0.5 моль
3. Сравниваем количество моль веществ и определяем недостаток:
0.5 моль 0.5 моль
в этом уравнении все не так очевидно, как в предыдущем, поэтому нужно просто прикинуть:
- если считать по азоту (0.5 моль), то по соотношению коэффициентов (2:5) кислорода должно быть в 2.5 раза больше, т.е. (0.5*2.5) 1,25 моль, а у нас только 0.5, значит, O2 в недостатке;
- если бы количество моль азота оказалось бы меньше, значит, считали бы по азоту
4. Вычисляем массу продукта по количеству моль, соответствующему недостатку:
m(N2O5) = n*Mr = 2* 0.55 моль * 108 гмоль = 21 г
______________________________________________________________________________________
Есть задачи, очень похожие на задачи избыток-недостаток,

1. Записываем уравнение реакции и уравниваем его:
здесь у нас возможно 2 варианта — образование средней и кислой соли:
2. Находим количество моль тех веществ, массы которых нам даны в условии:
n(CO2 ) = V22.4 лмоль = 24.9 22.4 = 1,11 моль
n(NaOH)= mMr = 44.440 = 1,11 моль
т.к. количество моль веществ одинаково, то делаем вывод, что реакция протекает по схеме образования кислой соли:
4. Вычисляем массу продукта по количеству моль:
m ( NaHCO3) = n*Mr = 1,11 * 84 = 93,24 г
_____________________________________________________________________________________ _
Задачи на избыток и недостаток не трудные, зачастую они являются частью более сложных задач, поэтому все, что нужно сделать, это натренироваться — порешать как можно больше таких примеров, внимательно уравнивая и работая с коэффициентами.
Секретная шпаргалка по химии. 3.4 Избыток-недостаток
“Я не сдам ЕГЭ, потому что у меня нет таланта! У Кати талант есть, у Паши – тоже есть, а у меня нет!” Сколько раз каждый из вас так думал? Много? Ха-Ха и еще раз Ха-Ха! Марк Твен говорил: «Существует тысяча причин для того, чтобы себя оправдать, но ни одной реальной». Секрет таланта и успеха на ЕГЭ я раскрою в конце статьи, а пока продолжаем изучать Стехиометрию. Сегодня разберемся с деликатной темой: избыток-недостаток в расчетах по уравнениям реакций.
В ряде задач представлены данные для обоих реагентов. Как в таких случаях выполнять расчеты по уравнения реакций? Что брать в качестве точки расчета? Давайте разбираться. Вначале определимся с понятиями.
Эквимолярное соотношение – равные количества веществ
Стехиометрическое соотношение – количества веществ в соответствии с коэффициентами в уравнении реакции
Для того, чтобы понять, в каких соотношениях представлены количества веществ-реагентов в конкретной задаче, необходимо начать анализ задачи по уже известным Четырем Заповедям . После выполнения Предварительных Расчетов (Третья Заповедь), следует выписать количества веществ над формулами реагентов в уравнении реакции и произвести пересчет количества одного вещества через количество другого. После определения избытка-недостатка дальнейшие расчеты в задаче производим по недостатку.
ПОМНИ. Расчеты по уравнению реакции производятся по НЕДОСТАТКУ!
Как определить избыток-недостаток и провести дальнейшие расчеты, лучше разобрать на конкретной задаче. Читайте внимательно и попробуйте записать решение задачи на отдельном листе бумаги.
На 47 г оксида калия подействовали раствором, содержащим 40 г азотной кислоты. Найдите массу образовавшегося нитрата калия.
1) Первая Заповедь. Выписать данные задачи в разделе “Дано”.
2) Вторая Заповедь. Написать уравнение реакции.
Немного теории химии. Оксиды щелочных металлов проявляют ярко выраженные основные свойства. Они легко реагируют с кислотами с образованием солей.
3. Третья Заповедь. Сделать предварительные расчеты по данным условия задачи
В условии задачи представлены данные по обоим реагентам – оксиду калия и азотной кислоте, поэтому определяем количество вещества каждого участника процесса.
На этой стадии необходимо определить, кто из реагентов в избытке, а кто в недостатке. Для этого следует провести пересчет количества одного вещества через количество другого. Покажу два способа пересчета и анализа. Можете пользоваться любым, какой понятней.
1) Считаем количество вещества азотной кислоты по количеству вещества оксида калия (обычный расчет по уравнению реакции). Читайте внимательно! Я мысленно произношу: “Пусть весь оксид калия вступил в реакцию. Сколько тогда прореагирует азотной кислоты?” И делаю расчет по уравнению реакции. Азотной кислоты, по расчетам, требуется больше, чем дано, значит, азотная кислота – в недостатке.
2) Считаем количество вещества оксида калия по количеству вещества азотной кислоты (обычный расчет по уравнению реакции). Я мысленно произношу: “Пусть вся азотная кислота вступила в реакцию. Сколько тогда прореагирует оксида калия?” Оксида калия, по расчетам, требуется меньше, чем дано, значит, оксид калия в избытке.
4. Четвертая заповедь. Составить алгоритм решения задачи.
Формулизируем вопрос задачи ” Найдите массу образовавшегося нитрата калия”, т.е. записываем формулу расчета массы, которая для нас, как для химиков, должна быть представлена произведением количества вещества на молярную массу. Анализируем компоненты формулы: молярную массу нитрата калия определяем по таблице Менделеева, количество вещества нитрата калия рассчитываем по уравнению реакции исключительно по недостатку !
Смешали 7,3 г хлороводорода и 4 г аммиака. Какая масса соли при этом образуется?
Немного теории. При смешивании хлороводорода и аммиака образуется густой белый дым (“дым без огня”) – кристаллики соли хлорида аммония.
Последовательность действия, выполняемых при решении задачи:
1) Выписать данные в разделе “Дано”
2) Написать уравнение реакции
3) Сделать предварительные расчеты.
4) Определить избыток-недостаток
5) Сделать расчет по уравнению реакции (по недостатку!)
6) Составить алгоритм решения
7) Сделать окончательный расчет
На 36 г алюминия подействовали 64 г серы. Найдите массу образовавшегося сульфида алюминия.
При поджигании смеси порошкообразных алюминия и серы между ними начинается интенсивная экзотермическая реакция с образованием сульфида алюминия, который полностью гидролизуется водой, поэтому не может быть получен обменными реакциями в водных растворах.
Последовательность действия, выполняемых при решении задачи:
1) Выписать данные в разделе “Дано”
2) Написать уравнение реакции
3) Сделать предварительные расчеты.
4) Определить избыток-недостаток
5) Сделать расчет по уравнению реакции (по недостатку!)
6) Составить алгоритм решения
7) Сделать окончательный расчет
Секрет таланта и успеха на ЕГЭ
Талант не дается от природы, он создается самим человеком. Это определенные способности, которые раскрываются с приобретением навыков и опыта. Успех на ЕГЭ зависит от ежедневного упорного труда и достижения мастерства в выбранном деле. Думаю, вывод не трудно сделать. Хотите добиться успеха – принимайтесь за работу!
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии http://repetitor-him.ru . Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Звоните мне +7(903) 186-74-55. Приходите ко мне на курс, на Мастер-классы “Решение задач по химии” – и вы сдадите ЕГЭ с высочайшими баллами, и станете студентом престижного ВУЗа!
PS! Если вы не можете со мной связаться из-за большого количества звонков от моих читателей, пишите мне в личку ВКонтакте, или на Facebook. Я обязательно отвечу вам.
Репетитор по химии и биологии кбн В.Богунова
Источники:
http://him.1sept.ru/2003/44/25.htm
http://distant-lessons.ru/zadachi-na-izbytok-i-nedostatok.html
http://zen.yandex.ru/media/id/5b5237690fd17e00a8a96f05/5bb37e8aa94f3f00aee2ddc1






Оставить комментарий